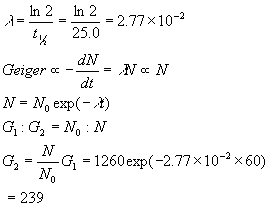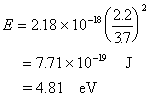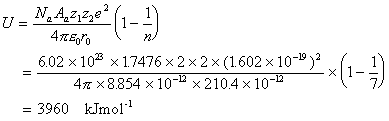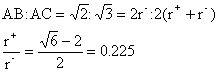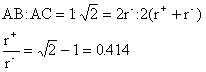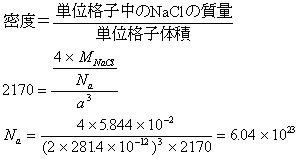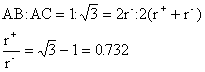無機化学Ⅰ |
| 無機化学Ⅰ演習問題解答 1.
2.
= 1.007825×8 + 1.008665×8 = 16.13192 mu 実際の質量 15.994915 mu 差分 0.137005 mu
3. ヨウ素-128 t? = 25.0 min.
K 1s22s22p63s23p64s1 Z*=19-(0.85×8+1×10)=2.2 n*=3.7
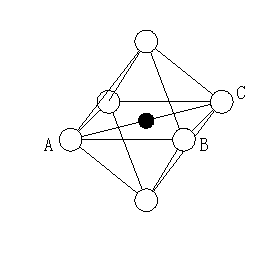
sp2混成によって平面内で3方向に軌道ができ、それぞれの軌道で結合電子対を形成している。そのためBを中心とする平面三角形となる。 NH3 N 1s22s22p3→1s2(2s2px2py2pz)4 sp3混成 sp3混成によってNを中心とする四面体の頂点方向に4つの軌道ができる。これらの軌道にはNから5個の電子がはいるため、一つの非共有電子対と3つの結合電子対を形成する。結果としてNH3はNを頂点とする三角錐の形となる。また、電子対反発則により、∠H-N-Hは正四面体の場合(109°28’)よりも小さな値となる。
(b)三方両錐 dsp3 (c)正八面体 d2sp3 (d)(歪んだ)三角錐 sp3 NH3と同じ。
8.
9. ボルン-ハーバーサイクル RbF(固) ← Rb+(気)+F-(気)
Rb(固)+1/2F2(気) → Rb(気)+F(気)
-552=78+402+80+x-762 x=-350 kJmmol-1 電子親和力 350 kJmol-1
原子間距離の2倍が単位格子の一辺となる。これを基準に密度を求める式を作る。
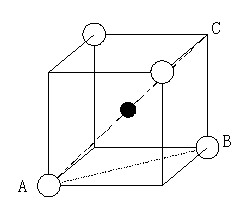
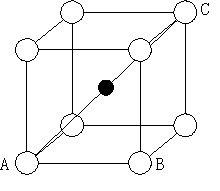
8. 8配位
立方体の一正方形を考える。
立方体の中心に陽イオンがあり、それが頂点の陰イオンと接しているので
|